▍来源:赛柏蓝 作者:张自然(医学博士)
2017年10月9日,《中药经典名方复方制剂简化注册审批管理规定(征求意见稿)》的发布,使中药经典名方复方制剂简化注册审批进入了实质运行阶段。
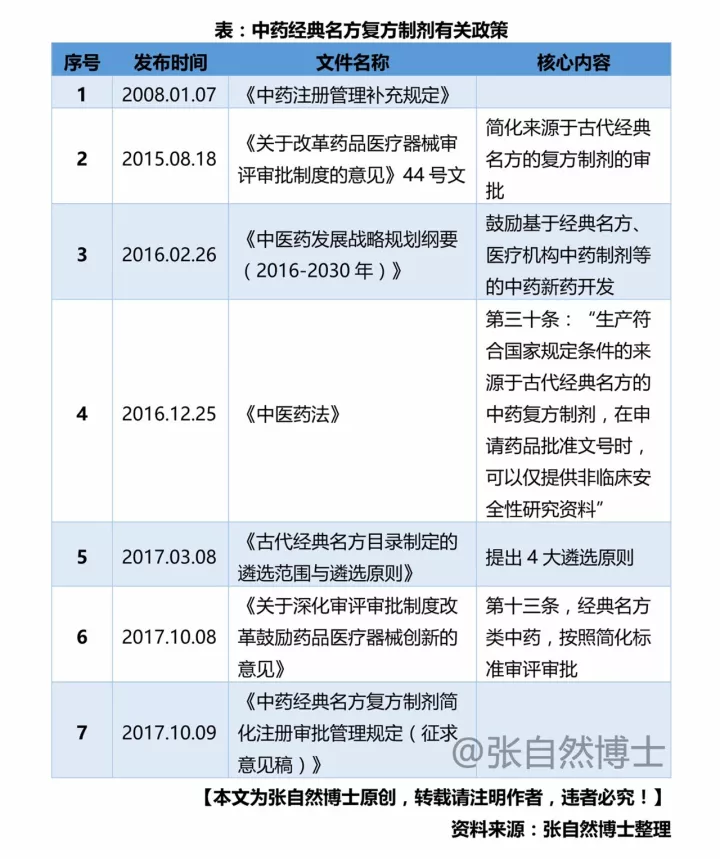
一、政策历程
二、遴选
1、遴选原则:1911年之前的中医医籍记载、至今广泛应用、疗效确切、特色明显。
2、实施简化注册审批的经典名方制剂应当符合的条件
据《中药经典名方复方制剂简化注册审批管理规定(征求意见稿)》附件1《中药经典名方复方制剂简化注册审批管理规定(征求意见稿)》规定,实施简化注册审批的经典名方制剂应当符合以下条件:

三、首批100首
1、遴选历程

2、剂型分析

四、质量标准
本次经典名方的质量标准“标准煎液”与2016年8月26日国家药典委发布的《中药配方颗粒质量控制与标准制定技术要求(征求意见稿)》中要求的中药配方颗粒的质量标准“标准汤剂”很类似。
(一)经典名方质量标准:标准煎液
1、作为经典名方制药用物质确定的基准;
2、除成型工艺外,其余制备方法应与古代医籍记载基本一致;
3、应固定方法、设备、工艺参数和操作规程;
4、通过出膏率、含量测定、指纹图谱或特征图谱等确保“标准煎液”批间质量基本一致及可追溯。
(二)中药配方颗粒质量标准:标准汤剂
1、作为衡量中药配方颗粒是否与临床汤基本一致的标准参照物;
2、按照临床汤煎煮方法规范化煎煮,固液分离,经适当浓缩制得或经适宜方法干燥制得;
3、标准汤系由不少于15批原料分别制得,计算相关均值,并规定其变异可接受的范围;
4、以出膏率、指纹图谱或特征图谱、主要成分含量的一致性为考察指标。
可见,上述两个标准在出膏率、指纹图谱、特征图谱等方面很一致,配方颗粒已经试点了15年,已有各级试点企业36家,年产值已过百亿,在质量标准等方面积累了丰富的经验,为经典名方质量标准“标准煎液”的研究提供了很好的基础和参考。
五、市场前景分析
通过分析配方颗粒、中药饮片、中成药、一致性评价产品、专利首仿药等细分市场的增长逻辑,预判经典名方制剂市场前景。

1、配方颗粒:前10多年靠全国仅6家的市场壁垒,近年又享有不取消加成、不占药占比、可报销、不统一招标等普通饮片共有的优势,才得以成为行业细分领域后起之秀;
2、一致性评价:除前3家门槛外,还有优先采购、优先使用等对原研替代的系列鼓励措施,才吸引药厂积极参与一致性评价;
3、中成药:前几年的医保扩容、优质优价、众多的独家品种和多年的历史基础,才造就了数百个过亿大品种;
4、仿制药:国家相继出台了专利抢仿、专利链接、专利期补偿、橙皮书、数据保护以及专利独占期等鼓励仿制药的组合措施,也使厂家看到了希望。
相对而言,经典名方制剂在将来的市场开拓方面尚欠缺必要的政策优势,尤其:
1、目前正值取消药品加成及辅助用药目录和重点监控目录频出之际,即使独家中成药现在推向市场在大医院增量都有一定压力;
2、何况,在全国3000多个独家中成药品种中,还有30%的独家品种处于休眠状态没有销量;
3、而如按古代医籍记载的方式标识功能主治的话,则将大医院中成药处方量的主力军西医医生排除在外,使其在大医院的销量更受限制;
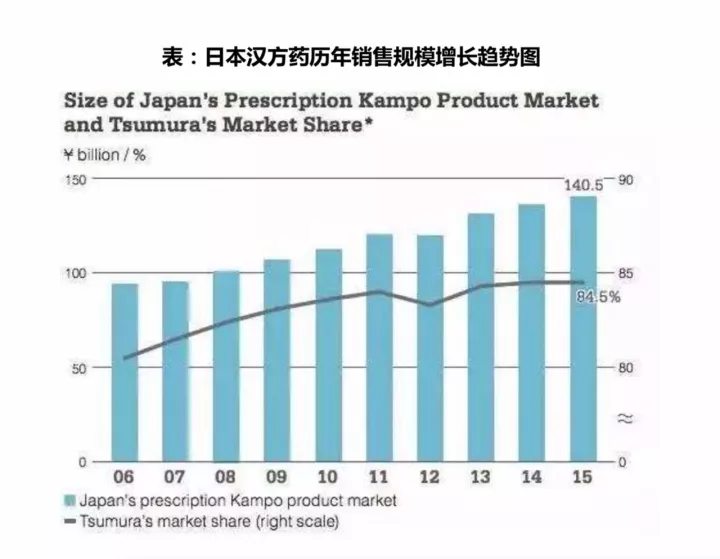
六、日本汉方
1、中成药与日本汉方药比较
日本汉方药的审批主要基于《一般用汉方制剂承认基准》,目前共收载医用汉方制剂处方(处方药)148个,另外,日本还有294个一般用汉方制剂(非处方药)。

2014年,日本汉方制剂生产总额为1581.1亿日元,占日本医药品总生产额的2.4%;
中国中成药2015年工业产值为7866亿RMB,占中国医药产业规模的28.55%。
2、日本汉方药市场规模
日本汉方制剂规模小、占医药行业比重少、西医化重,且津村一家独大,故和中国中药不可同日而语。
七、问题建议
1、问题
1)首家(批)优势不明显
附件1《中药经典名方复方制剂简化注册审批管理规定(征求意见稿)》
第八条:CDE在收到首家申请人提交的“标准煎液”相关资料后5日内,应当在其网站予以公示,公示期为六个月。公示期内,其他申请人可继续通过申报生产程序提交自行研制的该“标准煎液”相关资料,一并予以公示。公示期结束后,CDE组织专家开始对“标准煎液”进行审核。
分析:首家公示期6个月内有多家申报的可能。
第九条 鼓励申请人参与“标准煎液”标准的研究、起草并享有成果,在发布的“标准煎液”标准中标注起草单位的名称。
分析,仅仅是“享有成果”、“标注起草单位的名称”难以对市场销售形成实际价值。
2)定价、医保支付、医疗机构采购和使用等方面也未提及。
2、建议
如要鼓励经典名方制剂这个新生事物的发展,尚需对首家(批)产品的市场壁垒、定价、支付、采购、使用等方面给予倾斜,才能调动企业的积极性。