11月22日,中国食品药品检定研究院发布富马酸比索洛尔片、盐酸环丙沙星片、米索前列醇片、氯雷他定片等4个品种的拟推荐参比制剂以供药品生产企业参考。这4个品种都属于2018年需完成一致性平价的基药口服药289个品种清单的品种。
截至目前,中检院已公布289品种目录中的12个品种的拟推荐参比制剂。
表1 中检院公布12个品种拟推荐参比制剂名单
|
药品通用名
|
注册证号
|
生产厂商
|
产地
|
是否为289 目录品种
|
|
盐酸特拉唑嗪片
|
H20120136
|
Aesica Queenborough
|
英国
|
是,159号
|
|
富马酸喹硫平片
|
H20130035
|
AstraZeneca UK
|
英国
|
是,215号
|
|
富马酸喹硫平片
|
H20130037
|
AstraZeneca UK
|
英国
|
是,215号
|
|
盐酸环丙沙星片
|
H20150448
|
Bayer Pharma AG
|
德国
|
是,39号
|
|
盐酸环丙沙星片
|
H20150449
|
Bayer Pharma AG
|
德国
|
是,39号
|
|
奈韦拉平片
|
H20110483
|
BoehringerIngelheim Ellas A.E
|
希腊
|
是,199号
|
|
头孢呋辛酯片
|
H20130343
|
GLAXO OPERATIONS UK
|
英国
|
是,153号
|
|
吲达帕胺片
|
H20160320
|
LES LABORATOIRES SERVIER INDUSTRIE
|
法国
|
是,109号
|
|
辛伐他汀片
|
H20120263
|
Merck Sharp & Dohme
|
英国
|
是,91号
|
|
辛伐他汀片
|
H20130146
|
Merck Sharp & Dohme
|
英国
|
是,91号
|
|
马来酸依那普利片
|
H20160332
|
Merck Sharp & Dohme
|
英国
|
是,140号
|
|
马来酸依那普利片
|
H20160333
|
Merck Sharp & Dohme
|
英国
|
是,140号
|
|
富马酸比索洛尔片
|
H20160475
|
MerckKGaA
|
德国
|
是,248号
|
|
富马酸比索洛尔片
|
H20160474
|
MerckKGaA
|
德国
|
是,248号
|
|
米索前列醇片
|
H20150042
|
PIRAMA L HEALT HCARE UK
|
英国
|
是,277号
|
|
硫酸氢氯吡格雷片
|
H20140436
|
Sanofi WinthropIndustrie
|
法国
|
是,251号
|
|
氯雷他定片
|
H20160424
|
Schering-PloughLaboN.V.
|
比利时
|
是,94号
|
(数据来源:咸达数据V3.2)
29月企业备案数进一步下降
11月29日,中国食品药品检定研究院公开9月1日至30日期间备案信息,9月企业参比制剂备案数量进一步下降到414个。其中,企业“备案”下降到335个;企业“申报”(即认为自己生产的产品可作为参比制剂,主要是原研厂家以及在欧美上市的仿制药厂家申报)有所回升,为59个;行业推荐则是近3个月的最高,为20个。5~9月共备案2609个。
图1 5~9月企业参比制剂备案情况
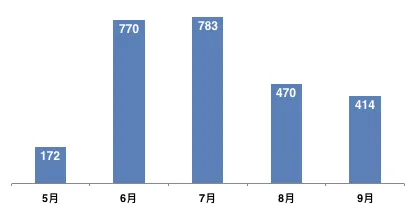
(数据来源:咸达数据V3.2)
表2 5~9月企业参比制剂各类别备案情况
|
2016年
|
备案
|
申报
|
推荐
|
总计
|
|
5月
|
164
|
8
|
|
172
|
|
6月
|
752
|
18
|
|
770
|
|
7月
|
650
|
117
|
16
|
783
|
|
8月
|
413
|
53
|
4
|
470
|
|
9月
|
335
|
59
|
20
|
414
|
|
总计
|
2314
|
255
|
40
|
2609
|
(数据来源:咸达数据V3.2)
其中,5~9月属于289目录品种的企业备案数共1425个,289个品种中共197个品种备案,占68%。但是,1324个序号数与289目录品种所需要完成的17,740个相比,还有很大的数据差,这意味着289目录品种在2018年时间点到达之后有缺药的风险,急需政府组织企业攻关。
行业推荐中,40个序号数中39个属于289目录品种,可见行业协会更关注最紧迫需要完成的任务目标。
表3 5~9月289目录品种企业参比制剂各类别备案情况
|
2016年
|
备案
|
申报
|
推荐
|
总计
|
|
5月
|
83
|
2
|
|
85
|
|
6月
|
415
|
10
|
|
425
|
|
7月
|
361
|
12
|
16
|
389
|
|
8月
|
249
|
19
|
3
|
271
|
|
9月
|
216
|
19
|
20
|
255
|
|
总计
|
1324
|
62
|
39
|
1425
|
(数据来源:咸达数据V3.2)
3进口地产化产品开始参与备案
阿莫西林胶囊、辛伐他汀片、苯磺酸氨氯地平片、奥美拉唑肠溶胶囊和盐酸二甲双胍片依然是一致性评价企业备案重点品种,同样也是289目录中最受企业关注的五大品种。预计此五大品种一致性评价的竞争将会非常激烈。
葵花药业集团(衡水)得菲尔有限公司是9月备案序号数最多的企业。5~9月备案序号数最多的企业则是石药集团欧意药业有限公司。
就在昨天(11月29日),CFDA发布的《总局办公厅公开征求进一步规范仿制药质量和疗效一致性评价参比制剂选择等相关事宜的指导意见的意见》和《总局办公厅公开征求仿制药质量和疗效一致性评价品种分类的指导意见的意见》主要针对进口药品地产化能否做参比制剂做进一步的规定。
早在9月,上海诺华贸易有限公司就备案了8个产品,分别是注射用阿莫西林钠克拉维酸钾、氢溴酸西酞普兰片、米氮平片、富马酸比索洛尔片、阿莫西林克拉维酸钾片(4:1)、卡泊三醇软膏、阿莫西林克拉维酸钾片和氯沙坦钾片,其中富马酸比索洛尔片和阿莫西林克拉维酸钾片属于289个品种目录产品。这从侧面反映了进口地产化产品也将会积极加入一致性评价的竞争中。
49月礼来申报最多
跨国药企申报方面,若说5月和6月申报数最多是拜耳,7月是辉瑞,8月是阿斯利康,9月则轮到礼来了。整体而言,5~9月申报数最多的跨国企业依然是辉瑞。
9月礼来申报了15个品种,分别是奥氮平口崩片、奥氮平片、精蛋白锌重组赖脯胰岛素混合注射液(25R)、精蛋白锌重组赖脯胰岛素混合注射液(50R)、精蛋白锌重组人胰岛素混合注射液、精蛋白锌重组人胰岛素注射液、赖脯胰岛素注射液、特立帕肽注射液、盐酸氟西汀分散片、盐酸氟西汀胶囊、盐酸雷洛昔芬片、重组人胰岛素注射液、注射用培美曲塞二钠、注射用盐酸吉西他滨和注射用盐酸万古霉素,大部分剂型是注射剂。
国内企业也有不少在9月首次申报自己产品为参比制剂。昆药集团股份有限公司申报复方磷酸萘酚喹片和天麻素注射液,河南蓝图制药有限公司申报盐酸左氧氟沙星片,常州制药厂有限公司申报复方利血平片,中国药科大学制药有限公司申报双氯芬酸钠缓释胶囊,浙江得恩德制药有限公司申报胶体果胶铋胶囊,北京麦迪海药业有限责任公司申报叶酸片,上海丽珠制药有限公司申报胰激肽原酶肠溶片。
5中国化学制药工业协会9月推荐16个产品参比制剂
5~9月,共有30个品种获得行业协会推荐。9月新增且只有中国化学制药工业协会推荐品种的参比制剂,共推荐16个品种,分别为环孢素软胶囊、格列美脲片、马来酸依那普利片、氢氯噻嗪片、氯氮平片、盐酸多西环素片、布洛芬缓释胶囊、蒙脱石散、醋酸地塞米松片、熊去氧胆酸片、盐酸哌唑嗪片、格列吡嗪片、复方利血平氨苯蝶啶片、聚乙二醇4000散、阿卡波糖胶囊和联苯双酯滴丸。其中,有2个产品中国化学制药工业协会推荐的参比制剂生产企业是国内企业,复方利血平氨苯蝶啶片的推荐企业是华润双鹤药业股份有限公司,联苯双酯滴丸则是北京协和药厂。
表4 5~9月行业协会推荐情况
|
协会名
|
7月
|
8月
|
9月
|
总计
|
|
浙江省医药行业协会
|
16
|
3
|
--
|
19
|
|
中国生化制药工业协会
|
--
|
1
|
--
|
1
|
|
中国化学制药工业协会
|
--
|
--
|
20
|
20
|
|
总计
|
16
.page_fy {PADDING-RIGHT: 3px; PADDING-LEFT: 3px; PADDING-BOTTOM: 3px; MARGIN: 3px; PADDING-TOP: 3px; TEXT-ALIGN: center}
.page_fy A {BORDER-RIGHT: #eee 1px solid; PADDING-RIGHT: 5px; BORDER-TOP: #eee 1px solid; PADDING-LEFT: 5px; PADDING-BOTTOM: 2px; MARGIN: 2px; BORDER-LEFT: #eee 1px solid; COLOR: #0a6b98; PADDING-TOP: 2px; BORDER-BOTTOM: #eee 1px solid; TEXT-DECORATION: none;outline:none;blr:expression(this.onFocus=this.blur());}
.page_fy A:hover {BORDER-RIGHT: #999 1px solid; BORDER-TOP: #999 1px solid; BORDER-LEFT: #999 1px solid; COLOR: #666; BORDER-BOTTOM: #999 1px solid}
.page_fy A:active {BORDER-RIGHT: #999 1px solid; BORDER-TOP: #999 1px solid; BORDER-LEFT: #999 1px solid; COLOR: #666; BORDER-BOTTOM: #999 1px solid}
.page_fy A.focus {BORDER-RIGHT: #0a6b98 1px solid; PADDING-RIGHT: 5px; BORDER-TOP: #0a6b98 1px solid; PADDING-LEFT: 5px; FONT-WEIGHT: bold; PADDING-BOTTOM: 2px; MARGIN: 2px; BORDER-LEFT: #0a6b98 1px solid; COLOR: #fff; PADDING-TOP: 2px; BORDER-BOTTOM: #0a6b98 1px solid; BACKGROUND-COLOR: #0a6b98;}
.page_fy .disabled {BORDER-RIGHT: #eee 1px solid; PADDING-RIGHT: 5px; BORDER-TOP: #eee 1px solid; PADDING-LEFT: 5px; PADDING-BOTTOM: 2px; MARGIN: 2px; BORDER-LEFT: #eee 1px solid; COLOR: #ddd; PADDING-TOP: 2px; BORDER-BOTTOM: #eee 1px solid}
.page_fy span{padding-left:5px;}
.page_fy span.off {border: 1px solid #EEEEEE;color: #ccc;margin: 2px;padding: 2px 5px;}
|