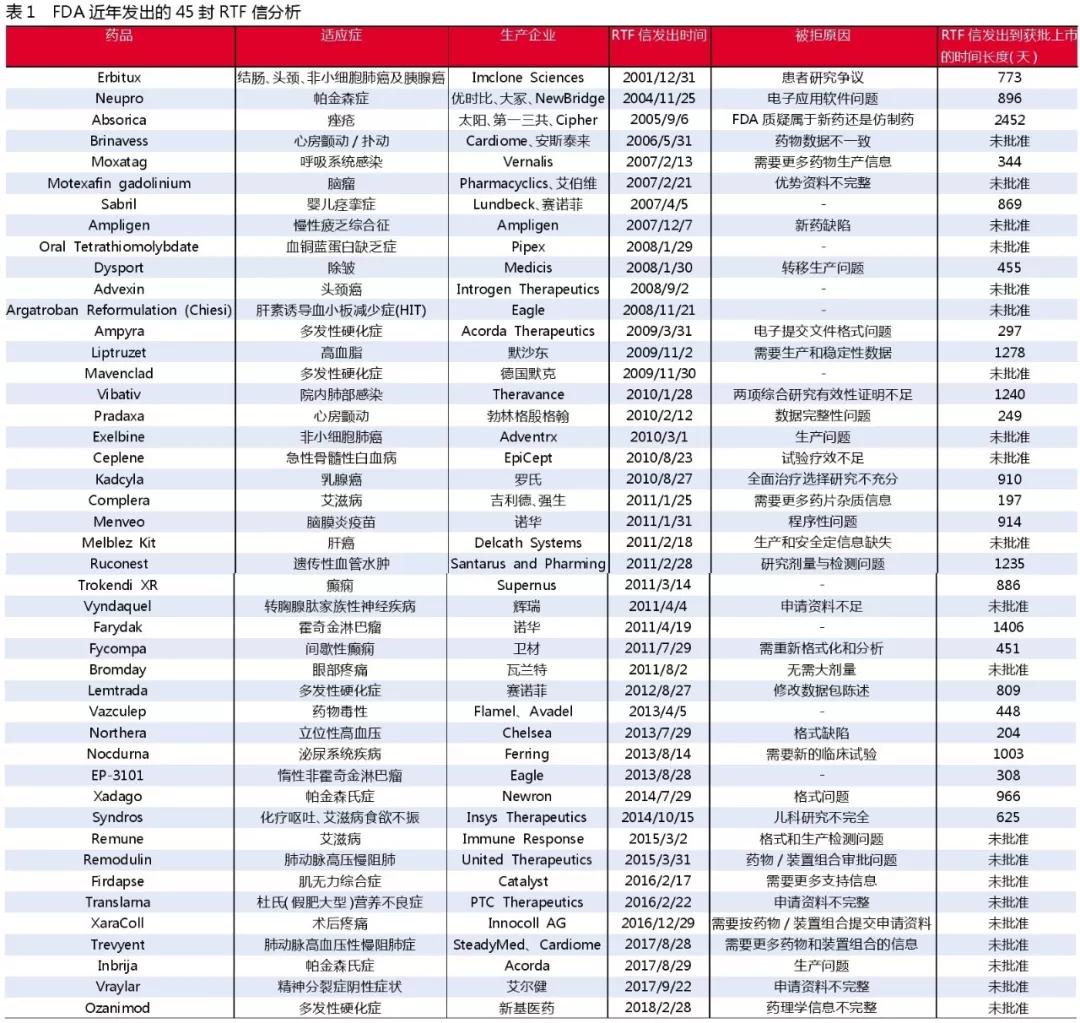
分析显示,FDA发出RTF信到新药最终获批上市之间的平均时长为800天,且自2015年以来收到RTF信的新药申请至今尚无一个获批。
Ozanimod是新基医药(Celgene)备受关注的多发性硬化症(MS)在研新药,其被认为是影响该公司未来发展的关键产品。但在近日,新基医药收到一封拒绝申请(Refuse to file,RTF)信,FDA拒绝对Ozanimod的上市申请文件进行完整审评。
收到RTF信对于一只等待上市的新药意味着什么?RTF信预示着所涉及的药物存在一些实际问题,而且大多数情况下,相关新药要等待相当长的时间才能获得批准。即使当时给出了似乎不是问题的延迟原因,影响审批时限的情况还是较为普遍。
平均800天后才获批
为了更清楚地观察RTF信对新药上市所带来的影响,福布斯专栏作者Matthew Herper分析了自2001年12月31日以来FDA发出的RTF信,对新药受其影响上市被延迟甚至未能上市的情况进行了梳理。
不同产品因RTF信受到延误的程度不尽相同。例如,吉利德科学(Gilead)与强生(Johnson & Johnson)的艾滋病药物康普莱(Complera)在收到FDA针对其注册申请的RTF信后6个月内就获得了批准,基本上未偏离其原定进程;而默沙东(Merck)的利普特鲁泽(Liptruzet,依泽麦布/阿托伐他汀)收到新药申请的RTF信后等了三年半才获批。
自2001年12月31日以来,共有45封RTF信发布。其中21封涉及存在问题的药物或新用途产品一直未获批准,占比达到47%。剩余的24封RTF信,从该信发出到所涉药物获批的时间跨度从217天到近7年不等。例如,前述的Complera复方新药用时217天,一种治疗痤疮的药物异维A酸(Absorica)胶囊用时近7年。
平均时长为800天,其中,14种药物在两年内未获批准,占比58%。此外,自2015年以来收到RTF信的药物和新药适应症申请,没有一个获得批准。
FDA近年发出的45封RTF信分析
(点击图片可放大)
新基MS新药分秒必争
何种情况下可以缩短审批延迟?在5起审批时限不到一年的案例中,FDA认为所申请药物对治疗疾病具有重要作用,足以证明其优先审查是合理的。另外2起涉及申请的格式问题。
新基医药还没有对Ozanimod的相关问题给出确切回复。投资银行Evercore/ISI的分析师乌默·拉法特(Umer Raffat)推测,上市申请被拒可能与药品的代谢物有关——即FDA希望详细说明药物在体内分解成其他化学物质的情况。这些问题需要多长时间才能解决,目前还不清楚。
但对于新基医药而言,时间很重要。芬戈莫德(Gilenya)是诺华(Novartis)的一种治疗MS的口服胶囊,其专利将于2019年2月18日到期,相关仿制药有望今年陆续得到暂时性获批。贝尔德(Baird)投行公司的分析师布赖恩·斯科尼(Brian Skorny)担忧,新基医药的进度落后于芬戈莫德仿制药将会削弱ozanimod 的销售潜力。两位分析人士均表示,该公司面临的最重要问题是,与仿制药企谈判,延缓其畅销抗癌药来那度胺(Revlimid)的竞争压力。
■编译 朱军生
■来源 福布斯
■编辑 陈雪薇